The importance of pineal brain sand and calcifications in the nervous tissue in the differential diagnosis of brain tumors
The importance of pineal brain sand and calcifications in the nervous tissue in the differential diagnosis of brain tumors
Abstract
According to many authors, the median survival of patients with brain tumors varies from several months to 5 years. There are no treatment methods leading to recovery at the present stage. At the present stage, it is necessary to search for key targets in the pathogenetic cascade of malignancy of the structures of the nervous tissue of the brain to develop a strategy for pathogenetically substantiated treatment.
Objective of the study: based on morphological, clinical and radiological data, to perform a comparative analysis of the histological and biochemical parameters of the pineal gland brain sand and brain calcifications. To assess the histogenetic features of the studied structures.
Materials and methods: the studies were conducted on 37 biopsies of human brain tumors using classical histological methods and analysis on an Olympus Bx52 microscope, with the production of illustrations with a PDx25 digital camera. The pineal gland brain sand was studied using phase-contrast microscopy.
Results of the study: age-related features of the brain sand of the pineal gland and brain were revealed. Features associated with the pathology of the nervous system of ischemic etiology were established. A proprietary conceptual model of the origin and significance of epiphyseal sand and psammosis bodies was proposed. Evidence of their significance in the pathogenesis of brain tumors was obtained.
Conclusion: neuronal intracellular and interstitial inclusions of sand in brain tumors and the pineal gland have different sources of development, differ functionally and are important in the malignancy of the nervous tissue of the brain. The data obtained in the study expand the range of diagnostic measures in identifying malignancy of brain structures and can be used in predicting the outcome and preventing relapse of tumors, and can also be considered as key target structures in the development of targeted conservative therapy for brain tumors.
The obtained histopathological data and comparative analysis of the pineal gland brain sand and psammous bodies of brain tumors will serve for the further development of magnetic resonance imaging (MRI) technologies and the expansion of diagnostic criteria for differential diagnosis and characterization of malignant tissues in vivo.
1. Введение
Несмотря на многочисленные методы исследования в онкологии, развитии молекулярно-генетических технологий, позволяющих выявить нарушения в геноме патологически измененных клеток, на современном этапе в решении проблем малигнизации в структуре нервной системы по-прежнему доминируют всего три вида лечения: лучевая терапия (ЛТ), химиотерапия (ХТ) и хирургические методы , , , . При этом медиана выживаемости пациентов с опухолями мозга варьирует по данным разных авторов от нескольких месяцев до 5 лет. Причины этого кроются в отсутствии общей концепции рака, понимания причини патогенеза малигнизации и источников опухолевых клеток. На этапе разработок находятся клеточные технологии и таргетная доставка лекарственных препаратов в опухоли. Классификация опухолей центральной нервной системы, принятая комиссией ВОЗ по опухолям мозга (Женева, 1976) учитывает 120 различных морфологических форм и не рекомендует для них классификацию TNM – раков висцеральных систем. Эту классификацию можно расширить, так как NGS, используемый в лабораторной онкологической практике, Oncomine Focus Assay, анализ, основанный на технологии секвенирования Ion Torrent позволяет детектировать до 1000 различных мутаций в 52 ключевых генах, связанных с развитием злокачественных опухолей, и ассоциированных с толерантностью к лучевой и химиотерапии , , . При этом наименее изучен патогенез псаммоматозной менингиомы — менгиготелиоматозной или фиброзной с большим количеством псаммомных телец (сorpora arenacea) .
Многие авторы считают, что эпифизарные песчинки и мозговой песок, формирующийся при малигнизации ткани головного мозга, являются идентичными структурами, имеющими в основе общие источники развития, одинаковый морфогенез и биохимический состав , . Однако псаммозные тельца опухолей мозга и эпифизарный песок (сorpora arenacea) и (corpora arenacea, acervulus) имеют значительные гистогенетические и физиологические отличия . Голубую флюоресценцию мозгового песка в ультрафиолетовых лучах связывают с наличием в песчинках фосфорнокислого кальция, отмечая идентичность с голубой флюоресценцией миелиновых оболочек , . Принято считать, что мозговой песок является результатом секреции пинеалоцитов, но гистоморфологические и иммуногистохимические данные, подтверждающие гипотетические положения о происхождении мозгового песка, на современном этапе отсутствуют . Множество точек зрения о развитии, значении мозгового песка в гистофизиологии мозга в целом порождает фантастические предположения о его функциональных возможностях, что ставит вопрос изучения мозгового песка эпифиза и псаммозных телец в опухолях мозга в ряд актуальнейших, требующих глубочайшего незамедлительного исследования , . Кровоснабжение опухолевой ткани имеет огромное значение для её прогрессии и прогноза . Образование новых сосудов необходимо для роста опухоли более 0,2 см в диаметре . В последнее время достигнут значительный прогресс в понимании механизмов неоангиогенеза опухолей, охарактеризованы индукторы и ингибиторы ангиогенеза, которые регулируют пролиферацию и миграцию эндотелиальных клеток. Облитерация сосудов кальцификатами может рассматриваться с позиции противостояния ткани мозга распространению малигнизации и адаптации для создания условий нарушения трофического обеспечения опухоли мозга. de Godoy ES, de Oliveira JRM (2024) указывают на связь псаммозных телец и инсультов после лучевой терапии . По мере появления новых методов МРТ крайне важно проверить, что очевидные аномальные особенности, наблюдаемые в исследованиях визуализации, коррелируют с гистопатологией. Taglia, I., Bonifati, V., Mignarri A., Dotti M.T., Federico, A. (2015) и Anheim M., Lopez-Sanchez U., Giovannini D., Richard A.C., Touhami J., N'guyen L. et al. (2016) наблюдали семейные мозговые кальцификации, Arii J., Tanabe Y., Makino M., Sato H., Kohno Y. (2002) отмечали кальцификаты у детей с гипотериоидитами , Guo X.‐X., Zou X.‐H., Wang C. (2024) также считают эти процессы наследственными , а Wang C., Li Y., Shi L., Ren J. (2024) показали связь кальцификатов с геномными нарушениями .
Эти спорные и дискутабельные факты послужили основой для выбора направления наших исследований.
Цель исследования. Повысить эффективность диагностики и лечения опухолей головного мозга человека.
Задачи исследования:
1. Изучить особенности мозгового песка эпифиза и кальцификатов опухолей мозга.
2. Установить значение изученных структур в дифференциальной диагностике, прогнозировании исхода опухолей и профилактике рецидивов.
3. Рассмотреть возможность использования данных о кальцификатах опухолей мозга в качестве ключевого морфологического субстрата для дополнения в патогенез малигнизации и разработки таргетной терапии опухолей головного мозга.
2. Материал и методы
Изучены 142 биоптата опухолей головного мозга, а также 98 эпифизов умерших пациентов различного возраста и пола, имеющих в анамнезе инсульт и шизофрению, а также опухоли висцеральных систем с метастазами в мозг. Из парафиновых блоков изготовлены срезы толщиной 5 мкм с последующей окраской гематоксилином и эозином. Микроскопический анализ выполнен на микроскопе Olympus BX53. Изображения гистологических слайдов были получены с помощью фирменного программного обеспечения для обработки изображений CellSens (Olympus Life Science, Токио, Япония), а цифровые слайды были подготовлены с помощью Aperio Scan Scope (Leica Biosystems Inc., Буффало, Гроув, Иллинойс).
3. Результаты исследований и их обсуждение
Установлено, что на фоне опухолей мозга идентифицируются исключительно округлые образования, соответствующие по форме кровеносным сосудам. Формирующиеся кальцификаты не выходят за пределы просвета и стенки кровеносного сосуда, могут быть представлены как одиночными образованиями, идентифицирующимися в просвете сосуда, так и располагаться диффузно в интерстиции опухоли. Не все сосуды подвергаются кальцификации, рядом с облитерированными сосудами идентифицируются неизмененные сосуды, содержащие в просвете эритроциты и лейкоциты. Нами отмечена динамика интенсивности кальцификации по вектору от периферии опухоли к центру (рисунок 1, 2, 3).
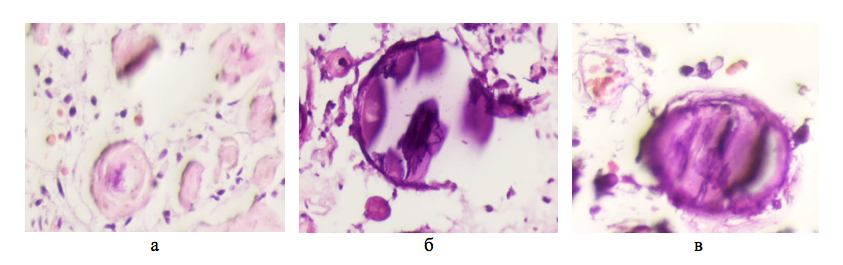
Рисунок 1 - Опухоль мозга человека 56 лет, псаммозные тельца в структуре опухоли мозга мужчины 59 лет
Примечание: окраска гематоксилином и эозином; микрофото, увеличение х400
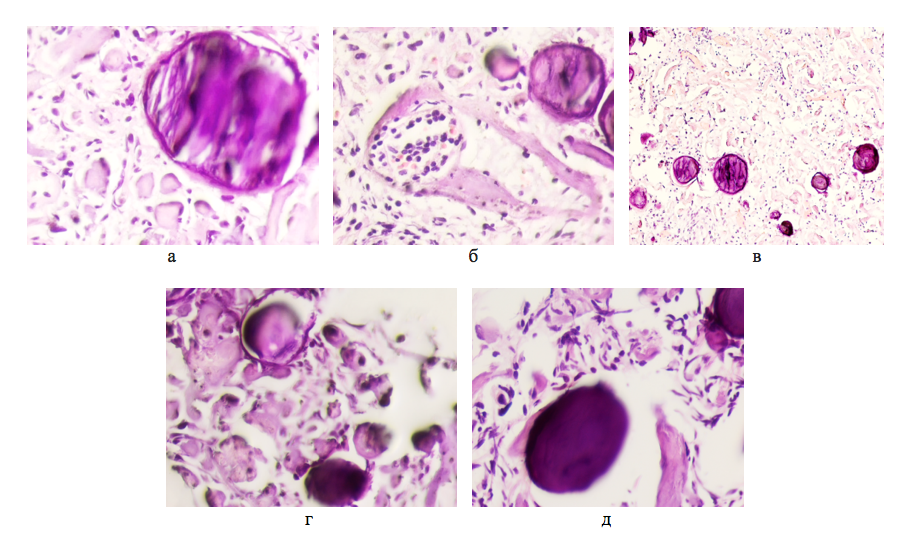
Рисунок 2 - Опухоль мозга мужчины 67 лет. Псаммозные тельца (а, б, в) и просвет кровеносного сосуда (б) с лейкоцитами и эритроцитами в структуре опухоли мозга
Примечание: окраска гематоксилином и эозином; микрофото увеличение а, б, г, д — х400; в — х200
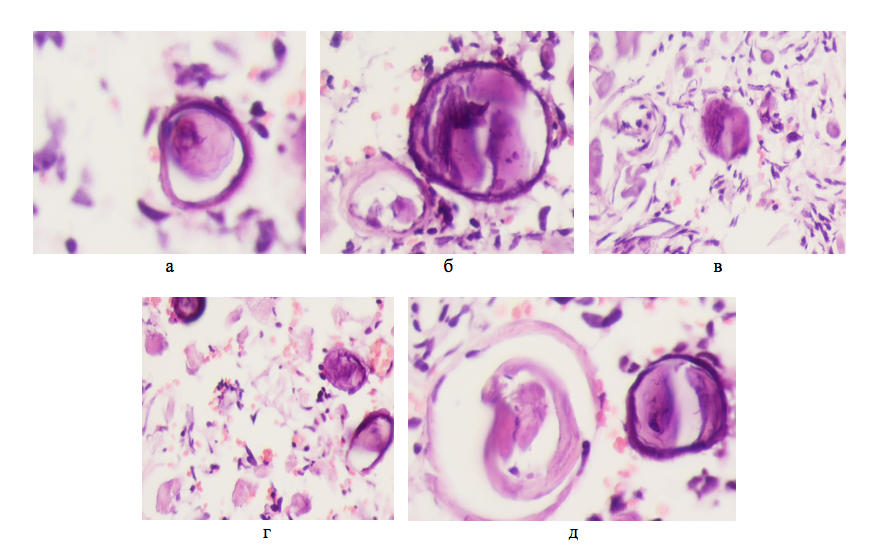
Рисунок 3 - Опухоль мозга человека 47 лет. Псаммозные тельца (а, б, в) и просвет кровеносного сосуда (г, д) с нитями фибрина не эндотелиального генеза в структуре опухоли
Примечание: окраска гематоксилином и эозином; микрофото увеличение а, б — х400; в — х200
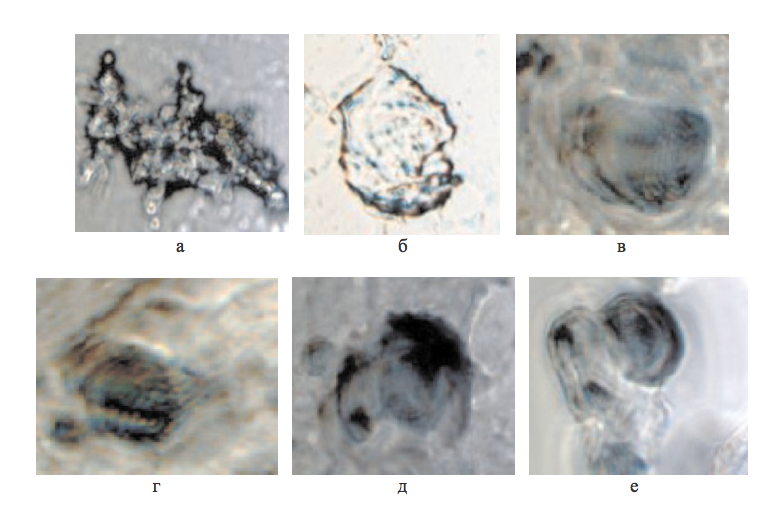
Рисунок 4 - Эпифиз человека 73 лет. Эпифизарный мозговой песок. Нативный препарат
Примечание: фазовоконтрастная микроскопия; микрофото, увеличение — x400
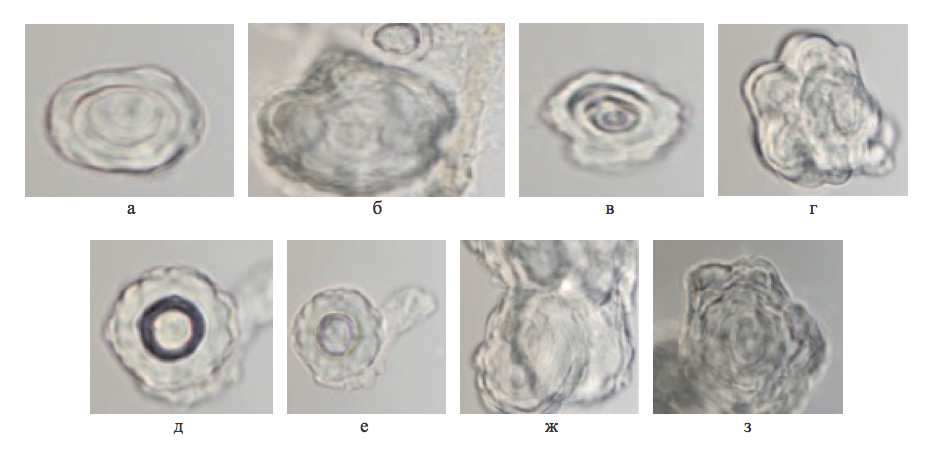
Рисунок 5 - Эпифиз человека 73 лет. Эпифизарный мозговой песок. Нативный препарат
Примечание: фазовоконтрастная микроскопия; микрофото увеличение — х400
4. Заключение
Результаты исследования и анализ доступной литературы по вопросу строения, источников развития и механизмов формирования эпифизарного песка и псаммозных телец опухолей мозга демонстрируют отличия и структурные особенности изученных структур. Эпифизарный песок в основе органического компонента имеет нейроглиальную природу, а псаммозные тельца опухолей мозга человека в основе органической составляющей имеют поврежденный, гиперплазированный, гипертрофированый и дистрофированный эпителий. Магнитные свойства эпифизарного песка, способность притягиваться к препаровальной металлической игле и другим металлическим предметам свидетельствует об особенностях не только структуры, химических и физических свойств, но и иной функциональной значимости. Тот факт, что мозговой песок эпифиза, в отличие от псаммозных телец, идентифицируется в структуре железы с 3-х лет и в течение всей жизни в норме, при этом отсутствует в эпифизе пациентов, страдающих шизофренией, что говорит о его физиологической значимости в психической деятельности человека. Мозговой песок эпифиза можно выделить полностью из структуры железы, он не связан с кровеносными сосудами, а псаммозные тельца, полностью облитерирующие кровеносные сосуды, связаны с окружением сосуда соединительной тканью адвентиции. Наличие клеток с голубым свечением в фазовоконтрастном микроскопе свидетельствует о нейрональном генезе и физиологической регенерации пинеальной железы человека с участием нейроглиальных клеток в образовании мозгового песка. Отсутствие интимных связей микроциркуляторного русла и эпифизарного песка может свидетельствовать о том, что его значение сильно преувеличено, или его влияние на организм может проявляться другими способами, не гуморального характера. Выполненные нами ранее исследования показали, что у больных с ишемией мозга кристаллы эпифизарного песка крупнее, что связано с более высокими процессами апоптоза глии у данной группы пациентов.
Таким образом, эпифизарный мозговой песок и псаммозные тельца опухоли мозга представляют собой различные структуры и требуют дальнейшего изучения. Увеличение количества и размеров песка в эпифизе человека с возрастом, а также большое его количество в эпифизе умерших от инсульта может свидетельствовать о том, что нейроглия эпифиза в результате хронической ишемии, изменения качества возрастного гемоглобина подвергается более высокому уровню процессов апоптоза и участвует в повышенном морфогенезе песка. Формирование псаммозных телец в опухолях мозга хотя и связано с гибелью эндотелиоцитов вследствие гипоксии, является первопричиной ишемии мозга, апоптоза нейронов и малигнизации. Наличие псаммозных телец в малигнизирующихся органах висцеральных систем и их наличие в щитовидной железе требует дополнительного изучения и подтверждения малигнизации, не как лоркального процесса, а результата системных нарушений в организме пациента с онкологической патологией.
