МОНИТОРИНГ МИКРОТРОМБОТИЧЕСКОГО РИСКА ПРИ ГЛИАЛЬНЫХ И МЕНИНГОТЕлиальных опухолях головного мозга
МОНИТОРИНГ МИКРОТРОМБОТИЧЕСКОГО РИСКА ПРИ ГЛИАЛЬНЫХ И МЕНИНГОТЕлиальных опухолях головного мозга
Аннотация
Опухоли головного мозга являются одним из преобладающих факторов риска развития венозных тромбоэмболических осложнений (ВТЭО). В частности, при глиомах нарушения системы гемостаза обусловлены ведущей ролью тканевого фактора и депрессией клеточной активации системы фибринолиза. В то же время оценка коагуляционного статуса при менингиомах практически не проводилась.
Цель исследования: оценки коагуляции у пациентов с глиомами и менингиомами головного мозга для прогноза микротромботического риска.
Материалы и методы: у 43 пациентов с глиомой и 54 пациентов с менингиомой головного мозга проведена оценка параметров гемостаза. Ретроспективно анализировалась основная информация о пациентах, характеристика новообразований по МРТ, сопутствующие заболевания и гистология опухолей, результаты лабораторных анализов крови до операции. Наличие тромбоза подтверждалось дуплексным сканированием вен нижних конечностей до и после хирургического лечения.
Частота развития ВТЭО среди пациентов с новообразованиями головного мозга составила 23,7%, в том числе: c глиомами – 25,6%, менингиомами – 22,2%. Значимыми факторами тромботического риска у пациентов с глиомой являются: понижение МНО, АЧТВ, фибриногена (р <0,01) и тромбоцитов (р <0,05), и повышение протромбина по Квику, D-димера (р <0,01) и лейкоцитов (р <0,05), увеличение возраста (р <0,001), сопутствующая артериальная гипертензия и IDH-wildtype фенотип (р <0,05). У больных с менингиомой – повышение D-димера (р <0,01), увеличение возраста и сопутствующие ожирение (р <0,05). При проведении корреляционного анализа Спирмена в группе с глиомами было показано, что повышение уровня D-димера коррелирует с увеличением Ki67 (R=0,532, р <0,01) и степенью Grade (R=0,406, р <0,05), и увеличение количества лейкоцитов положительно коррелирует с объемом новообразования (R=0,561, р <0,001), Grade (R = 0,428, р=0,01) и Ki67 (R=0,397, р <0,05).
Повышенный риск развития ВТЭО связан с гиперкоагуляцией у пациентов с глиомами и менингиомами головного мозга. Увеличение D-димера и лейкоцитов коррелирует с прогрессированием глиом.
1. Введение
Развитие венозных тромбозов является распространенным осложнением в практике лечения внутричерепных объемных образований головного мозга, встречающимся до 30%, что делает исследование данной проблемы актуальным в современной нейроонкологии
. Примечательно, что ТЭЛА является одной из основных причин смерти нейрохирургических пациентов, особенно вследствие асимптомных тромбозов глубоких вен (ТГВ), уровень смертности которой колеблется от 9% до 50% . Проблема ВТЭО в нейрохирургии стала активно обсуждаться во второй половине 20 века, начиная с исследований M. Anderson и T. Shields (1958) и N. Wetzel и соавт. (1960) , . Как известно, любой вид новообразований, независимо от локализации, увеличивает вероятность тромбозов и венозных тромбоэмболических осложнений (ВТЭО), особенно у пациентов с опухолями головного мозга . Для подтверждения этого факта можно привести результаты работы P.D. Stein с соавт., которые изучили частоту развития ВТЭО у больных с онкологическими заболеваниями различных органов. Результаты показали, что пациенты с опухолью головного мозга занимают второе место по частоте возникновения ВТЭО после больных раком поджелудочной железы, опередив пациентов с кроветворными опухолями, опухолями желудка, печени, и других органов . Этот феномен объясняется несколькими причинами: секрецией веществ опухолью, способствующих агрегации тромбоцитов и свертыванию крови, инвазией сосудистой стенки опухолью и отдаленным выделением провоспалительных и проангиогенных цитокинов, которые стимулируют активацию эндотелиоцитов и компонентов клеточного гемостаза .В работе S. Shi и др. выделили значимые факторы риска развития ВТЭО в нейроонкологии, которые являются: пожилой возраст, увеличение ИМТ (индекса массы тела), ускорении АЧТВ, повышение концентрации D-димера до операции, а также гистологический тип опухоли головного мозга и увеличении длительность оперативного вмешательства
. В ретроспективном исследовании А.В. Бервицкого и др. отметили, что наиболее значимыми факторами возникновения ВТЭО для пациентов с глиомами являются: возраст более 55 лет, женский пол, ИМТ более 30 кг/м2, продолжительность оперативного вмешательства более 4 часа, длительный период пребывания в отделении анестезиологии и реанимации не менее 12 часов. Для менинготелиальных опухолей являлись значимыми факторами следующие: мужской пол, ИМТ более 30 кг/м2, продолжительность оперативного вмешательства более 45 минут, длительный период пребывания в отделении анестезиологии и реанимации не менее 12 часов .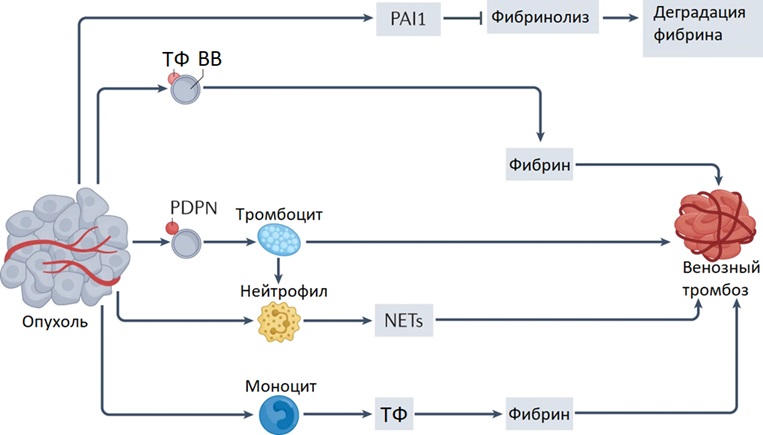
Рисунок 1 - Потенциальные механизмы тромбоза, связанного с глиомами
Примечание: ТФ – тканевой фактор; ВВ – внеклеточные везикулы; PDPN – подопланин; PAI1 – ингибитор активатора плазминогена 1; NETs – нейтрофильные внеклеточные ловушки
Периоперационная антикоагулянтная профилактика венозной тромбоэмболии у нейроонкологических пациентов не получила широкого распространения из-за опасения внутричерепного кровотечения. Однако существует ряд публикаций, демонстрирующих безопасность профилактики ВТЭО с помощью низкомолекулярных гепаринов (НМГ) или прямых пероральных антикоагулянтов (ПОАК), после нейрохирургических операций
, . Несколько ретроспективных исследований показали, что риск ВМК при приеме ПОАК такой же или меньше, чем при использовании НМГ . Поэтому вопрос о целесообразности и сроках проведения профилактики с помощью антикоагулянтов в нейрохирургии остается открытым, дискутабельным и нуждается в дальнейших исследованиях.Предоперационная диагностика коагуляционного гемостаза позволит дополнительно оценить вероятность возникновения риска ВТЭО у пациентов с интракраниальными опухолями головного мозга и приблизить нейрохирургов и врачей смежных специальностей к обоснованию назначения персонифицированной тромбопрофилактики, что имеет несомненное практическое значение в нейроонкологии. Существуют немногочисленные исследования коагуляционного профиля глиом
, , , в то же время подробного изучения коагуляционного статуса при менингиомах практически не проводилась.Цель настоящего исследования: проведение профильной оценки коагуляции у пациентов с глиомами и менингиомами головного мозга для прогноза тромботического риска.
2. Материалы и методы
В данном клиническом исследовании оценивались коагуляционный профиль, общий анализ крови (ОАК) и анамнестические данные у пациентов с впервые выявленными злокачественными новообразованиями головного мозга и доброкачественными новообразование мозговых оболочек, поступивших в отделение нейроонкологии ФГБУ «Федеральный центр нейрохирургии» Минздрава России г. Новосибирска. Критериями включения были пациенты в возрасте от 18 до 75 лет, перенесшие операцию по поводу глиомы или менингиомы головного мозга. Критериями исключения были: возраст моложе 18 и старше 75 лет, рецидивы опухолей головного мозга, другая первичная опухоль или доказанный метастаз, наличие хронической сердечной недостаточности III—IV функционального класса по классификации NYHA, аутоиммунные заболевания, беременность, доказанные гематогенные тромбофилии высокого риска (дефициты AT-3, протеинов C/S, гомозиготы в генах FV-Leiden, протромбина G20210A) декомпенсированная печеночная или почечная недостаточность, фибрилляция предсердий; острое нарушение мозгового кровообращения или инфаркт миокарда давностью менее 6 мес, прием комбинированных оральных контрацептивов, регулярный прием антикоагулянтов и антиагрегантов, пролонгированная кортикостероидная терапия.
Исследование было одобрено локальным этическим комитетом ФГБУ «ФЦН» (г. Новосибирск) (протокол №124 от 25.09.2023 г.), и каждый образец крови собирался после получения информированного подписанного согласия.
Ретроспективно анализировалась основная информация о пациентах, включая возраст, пол, индекс массы тела (ИМТ), характеристика новообразований по МРТ (объем опухоли рассчитывался по упрощенной формуле для расчета объема эллипсоида), сопутствующие заболевания. Наличие ТГВ подтверждалось дуплексным сканированием вен нижних конечностей до и после хирургического лечения. Забор крови осуществлялся до начала хирургического лечения системой Vacutainer в вакуумные пробирки, содержащие 3,2% цитрата натрия и ЭДТА. Количественный анализ образцов на концентрацию гемоглобина (Hb), количество эритроцитов, лейкоцитов и гематокрит проводили с помощью автоматического анализатора Sysmex XS 1000i (Sysmex, Кобе, Япония). Для проведения коагуляционных исследований АЧТВ, МНО, протромбин по Квику, фибриноген, D-димер, АТ III использовали коагулометр «Sysmex CA-560» (Sysmex, Кобе, Япония).
Диагноз опухоли подтверждался по результатам гистологического и иммуногистохимического обследования операционного материала с использованием классификации Всемирной организации здравоохранения 2021 г. . Маркеры глиом IDH1(R132H) (Мутация R132H изоцитратдегидрогеназы 1) и Ki67 (биомаркер пролиферации) определялись иммуногистохимическим методом.
Все полученные данные обрабатывались с помощью программного пакета для статистической обработки IBM SPSSStatistics27 (StatSoft, Inc., CШA). Анализ нормальности распределения выборки осуществлялся с использованием критерия Колмогорова–Смирнова, и получено, что распределение ненормально. Поэтому использовался U-критерий Манна-Уитни для оценки различий по всем параметрам между группами пациентов с глиомами и менингиомами. Дискретные данные анализировали с использованием точным двусторонним критерием Фишера. Непрерывные переменные выражались в виде медианных значений и квартилей Q1-Q3. Дискретные переменные представляли в виде числа и процента. Были рассчитаны скорректированные отношения шансов (ОШ) с 95% доверительными интервалами (ДИ). Корреляционную связь оценивали с помощью коэффициента ранговой корреляции Спирмена. Cтатистически значимые различия считались при значениях p<0,05.
3. Основные результаты
В данном исследовании 97 пациентов с опухолями головного мозга соответствовали критериям включения-исключения. За период нахождения в стационаре ТГВ был диагностирован у 23 пациентов (23,7%), который был установлен до хирургического лечения в 30,4% случаев, после — в 69,6%. Наиболее распространенными сопутствующими патологиями были артериальная гипертензия — 61,9%, варикозная болезнь нижних конечностей — 43,3%, ожирение — 38,1%.
Статистическое сравнение проводилось с и без ВТЭО между 11 (25,6%) и 32 пациентами в группе с глиомами, и, 12(22,2%) и 42 в группе с менингиомами.
В когорте с глиомами средний возраст на момент госпитализации составлял 50±14лет. Из 43 пациентов было 23 (53,5%) мужчин и 20 (46,5%) женщин. Медиана объема глиомы по данным МРТ составила 48,510 [22,433; 69,270] см3. Медиана ИМТ у пациентов составила 27 [25;30] кг/м2, а частота выраженного неврологического дефицита в виде пареза — 18,6%. С помощью иммуногистологического исследования были верифицированы 11 астроцитом (25,6%), 9 олигодендроглиом (20,9%) и 23 глиобластом (53, 5%), часть которых соответствовали Grade 2 и составили 25,6%, Grade 3 — 7,0%, Grade 4 — 67,4%.
По лабораторным данным в отношении глиом с ВТЭО были выявлены значимо пониженные значения МНО, АЧТВ, фибриногена (р <0,01) и тромбоцитов (р<0,05), и повышенные — протромбина по Квику и D-димера (р<0,01), лейкоцитов (р<0,05) (табл. 1), (рис. 2).
Таблица 1 - Сравнение лабораторных показателей пациентов cглиомами без и с ВТЭО
Исследуемые параметры | Группа без ВТЭО, Ме [Q1; Q3] | Группа с ВТЭО, Ме [Q1; Q3] | p-значение |
n | 32 | 11 | |
Протромбин по Квику, % | 92,7 [82,5; 109,6] | 117,1 [104,5; 121,8] | 0,004* |
МНО, отн. ед. | 1,03 [0,95; 1,09] | 0,92 [0,90; 0,97] | 0,005* |
АЧТВ, c | 30,6 [27,6; 33,3] | 24,5 [23,0; 28,0] | 0,002* |
Фибриноген, г/л | 2,65 [2,28; 3,16] | 1,86 [1,41; 2,46] | 0,007* |
D-димер, мг/л | 0,37 [0,10; 0,75] | 1,58 [0,75; 3,64] | 0,004* |
Aнтитромбин III, % | 107 [99; 114] | 106 [94; 118] | 1,000 |
Гемоглобин, г/л | 137 [127; 151] | 143 [133; 162] | 0,302 |
Эритроциты, 1012/л | 4,9 [4,3; 5,1] | 4,7 [4,4; 5,5] | 0,546 |
Лейкоциты, 109/л | 9,2 [7,1; 11,5] | 11,7 [10,6; 14,7] | 0,046* |
Тромбоциты, 109/л | 285[235; 342] | 215 [180; 272] | 0,026* |
Гематокрит, % | 41 [37; 44] | 41 [40; 46] | 0,546 |
Примечание: * — статистически значимое различие; МНО - международное нормализованное отношение; АЧТВ - активированное частичное тромбопластиновое время
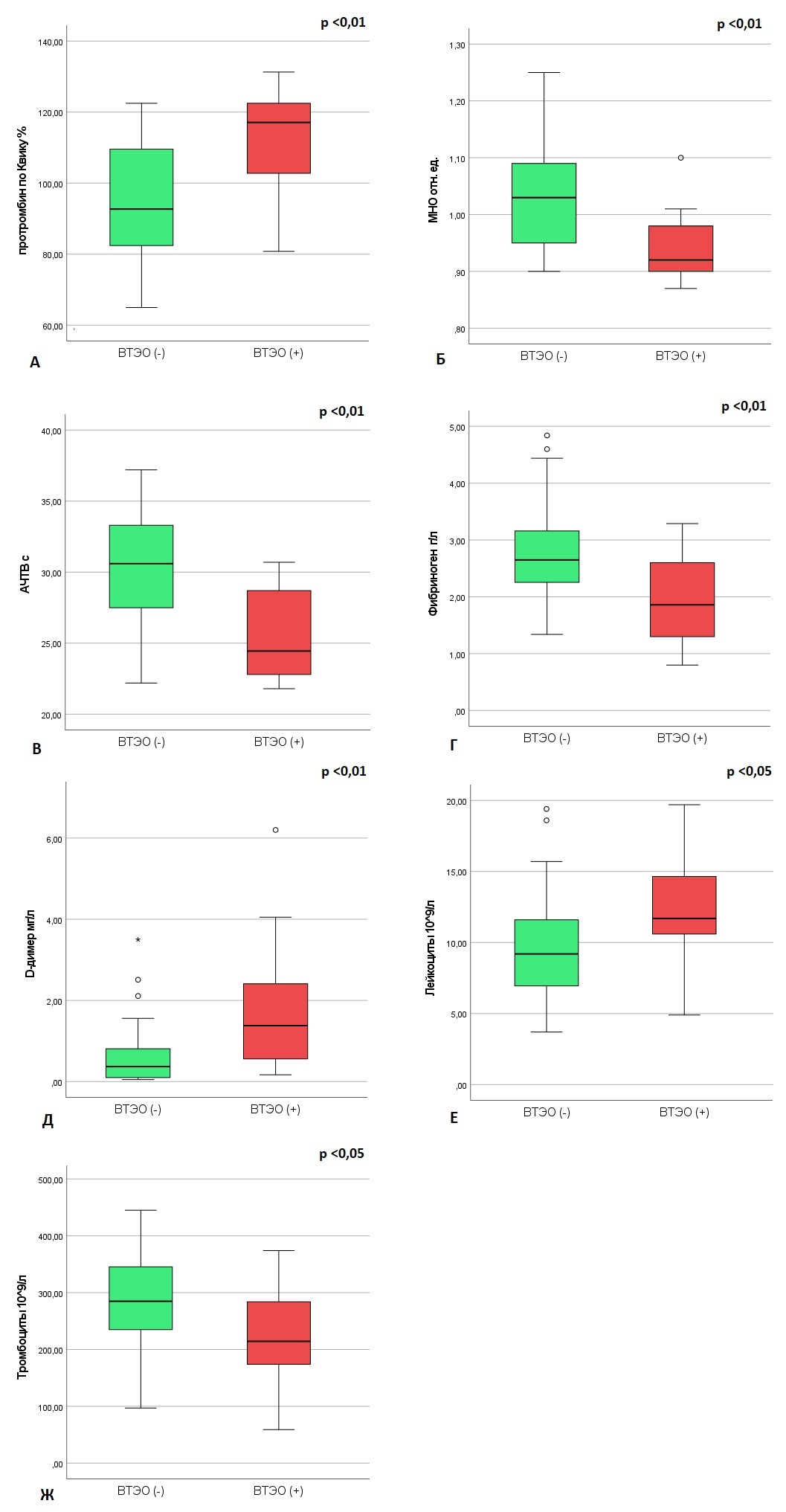
Рисунок 2 - Уровни в плазме:
А – протромбина по Квику; Б – МНО; В – АЧТВ; Г – фибриногена; Д – D-димера; Е – лейкоцитов; Ж – тромбоцитов у пациентов с глиомами без/с ВТЭО
Сравнивая клинические данные в группе глиом без/c ВТЭО выявлено, что пациенты старше 60 лет продемонстрировали наибольшую статистическую связь с ВТЭО (р<0,001). Также артериальная гипертензия и фенотип IDH-wildtype оказались категориальными факторами, связанными с ВТЭО (р<0,05) (табл. 2).
Таблица 2 - Частота встречаемости специфических факторов риска ВТЭО у пациентов с глиомами
Факторы риска | Группа без ВТЭО | Группа с ВТЭО | ОШ (95% ДИ) | p-значение | ||
n | 32 | 11 | ||||
Ассоциированные с пациентом | ||||||
- | n | % | n | % | - | |
<44 лет | 14 | 32,6 | 0 | 0 | 0 | <0,001* |
45–59 лет | 14 | 32,6 | 3 | 7,0 | 0,482 (0,108-2,160) | |
>60 лет | 4 | 9,3 | 8 | 18,6 | 18,667 (3,442-101,231) | |
Мужчины | 19 | 44,2 | 4 | 9,3 | 2,558 (0,620-10,546) | 0,192 |
Женщины | 13 | 30,2 | 7 | 16,3 | 0,391 (0,095-1,612) | |
Артериальная гипертензия | 15 | 34,9 | 9 | 20,9 | 5,100 (0,948-27,424) | 0,047* |
Варикозная болезнь вен нижних конечностей | 10 | 23,3 | 5 | 11,6 | 1,833 (0,451-7,454) | 0,399 |
Ожирение | 10 | 23,3 | 3 | 7,0 | 0,825 (0,180-3,783) | 0,957 |
Парез конечностей | 6 | 14,0 | 2 | 4,7 | 0,963 (0,164-5,658) | 0,967 |
Ассоциированные с опухолью | ||||||
Grade 2 | 10 | 23,3 | 1 | 2,3 | 0,220 (0,025-1,961) | 0,068 |
Grade 3 | 3 | 7,0 | 0 | 0 | 0 | |
Grade4 | 19 | 44,2 | 10 | 23,3 | 6,842 (0,779-60,126) | |
Астроцитомы | 9 | 20,9 | 2 | 4,7 | 0,568 (0,102-3,156) | 0,075 |
Олигодендроглиомы | 9 | 20,9 | 0 | 0 | 0 | |
Глиобластомы | 14 | 32,6 | 9 | 20,9 | 5,786 (1,074-31,164) | |
IDH-wildtype | 14 | 32,6 | 9 | 20,9 | 5,786 (1,074-31,164) | 0,031* |
Примечание: * — статистически значимое различие; IDH-wildtype– Изоцитратдегидрогеназа дикого типа
Также экспрессия Ki67 у глиом, был значительно выше у пациентов с тромботическими явлениями (р<0,05).
В когорте с менингиомами средний возраст на момент госпитализации составлял 53±12года. Из 54 пациентов было 12 (22,2%) мужчин и 42 (77,8%) женщин. Медиана объема менингиом по МРТ — 21,955 [9,806; 56,976] см3. Медиана ИМТ — 28 [24; 32] кг/м2, а частота выраженного неврологического дефицита в виде пареза — 7,4%. Были верифицированы 2 ангиоматозных менингиом (3,7%), 8 фибробластических менингиом (14,8%), 10 менинготелиальных менингиом (18,5%), 19 переходных менингиом (35,2%), 15 атипичных менингиом (27,8%), часть которых соответствовали Grade 1 и составили 72,2%, Grade 2 — 27,8%.
Статистически значимо наблюдался дооперационный повышенный уровень D-димера в группе с ВТЭО (р<0,01) (табл. 3), (рис. 3).
Таблица 3 - Сравнение лабораторных показателей пациентов cменингиомами без и с ВТЭО
Исследуемые параметры | Группа без ВТЭО, Ме [Q1; Q3] | Группа с ВТЭО, Ме [Q1; Q3] | p-значение |
n | 42 | 12 | |
протромбин по Квику, % | 96,5 [88,2; 107,2] | 106,1 [95,6; 112,6] | 0,109 |
МНО, отн. ед. | 1,01 [0,96; 1,07] | 0,97 [0,93; 1,02] | 0,122 |
АЧТВ, c | 31,5 [28,8; 34,4] | 28,8 [26,7; 31,4] | 0,081 |
Фибриноген, г/л | 2,46 [2,14; 2,87] | 2,16 [2,09; 2,89] | 0,430 |
D-димер, мг/л | 0,35 [0,15; 0,48] | 0,56 [0,43; 1,79] | 0,009* |
Aнтитромбин III, % | 103 [100; 114] | 110 [105; 124] | 0,060 |
Гемоглобин, г/л | 130 [123; 141] | 124 [121; 128] | 0,274 |
Эритроциты, 1012/л | 4,5 [4,2; 4,8] | 4,3 [3,9; 4,8] | 0,222 |
Лейкоциты, 109/л | 6,5 [6,0; 7,5] | 7,4 [6,8; 7,7] | 0,087 |
Тромбоциты, 109/л | 265 [242; 299] | 240 [210; 278] | 0,139 |
Гематокрит, % | 39 [36; 41] | 36 [35; 40] | 0,232 |
Примечание: * — статистически значимое различие; МНО - международное нормализованное отношение; АЧТВ - активированное частичное тромбопластиновое время
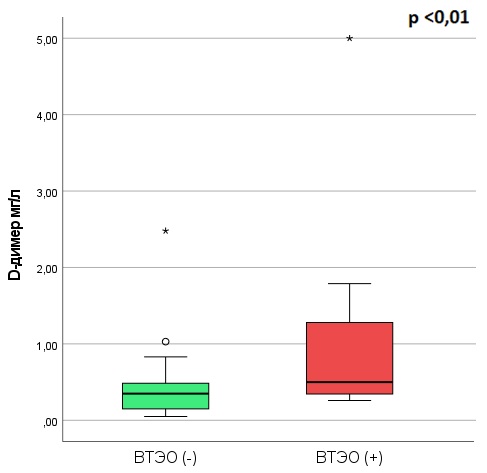
Рисунок 3 - Уровни в плазме D-димера у пациентов с менингиомами без/с ВТЭО
Таблица 4 - Частота встречаемости специфических факторов риска ВТЭО у пациентов с менингиомами
Факторы риска | Группа без ВТЭО | Группа с ВТЭО | ОШ (95% ДИ) | p-значение | ||
n | 42 | 12 | ||||
Ассоциированные с пациентом | ||||||
- | n | % | n | % | - | |
<44 лет | 15 | 27,8 | 2 | 3,7 | 0,360(0,070-1,864) | 0,027* |
45–59 лет | 13 | 24,1 | 1 | 1,9 | 0,203(0,024-1,740) | |
>60 лет | 14 | 25,9 | 9 | 16,7 | 6,000(1,400-25,724) | |
Мужчины | 10 | 18,5 | 2 | 3,7 | 0,640 (0,120-3,420) | 0,603 |
Женщины | 32 | 59,3 | 10 | 18,5 | 1,563 (0,292-8,351) | |
Артериальная гипертензия | 26 | 48,1 | 10 | 18,5 | 3,077 (0,596-15,878) | 0,169 |
Варикозная болезнь вен нижних конечностей | 20 | 37,0 | 7 | 13,0 | 1,540 (0,421-5,637) | 0,517 |
Ожирение | 16 | 29,6 | 9 | 16,7 | 4,875 (1,146-20,731) | 0,025* |
Парез конечностей | 4 | 7,4 | 0 | 0 | 0 | 0,271 |
Ассоциированные с опухолью | ||||||
Grade 1 | 32 | 59,3 | 8 | 14,8 | 0,625 (0,155-2,521) | 0,511 |
Grade 2 | 10 | 18,5 | 4 | 7,4 | 1,600 (0,397-6,453) | |
Атипичные менингиомы | 11 | 20,4 | 4 | 7,4 | 1,409 (0,353-5,620) | 0,922 |
Менинготелиальные менингиомы | 10 | 18,5 | 0 | 0 | 0 | |
Переходные менингиомы | 12 | 22,2 | 7 | 13,0 | 3,500 (0,927-13,216) | |
Фибробластические менингиомы | 7 | 13,0 | 1 | 1,9 | 0,455 (0,050-4,111) | |
Ангиоматозные менингиомы | 2 | 3,7 | 0 | 0 | 0 | |
Примечание: * — статистически значимое различие
При проведении корреляционного анализа Спирмена в группе с глиомами наблюдалась положительная корреляция между значениями D-димера и Ki67 (R = 0,532, р<0,001) и степенью Grade (R = 0,406, р <0,05), тем самым подтверждается, что при прогрессировании опухоли увеличивается активность тромбообразования. Также количество лейкоцитов положительно коррелирует с объемом новообразования (R = 0,561, р<0,001), Grade (R = 0,428, р=0,01) и Ki67 (R = 0,397, р <0,05), что обозначает связь увеличения размеров и степени злокачественности опухоли с усилением воспалительного процесса (рис. 4).
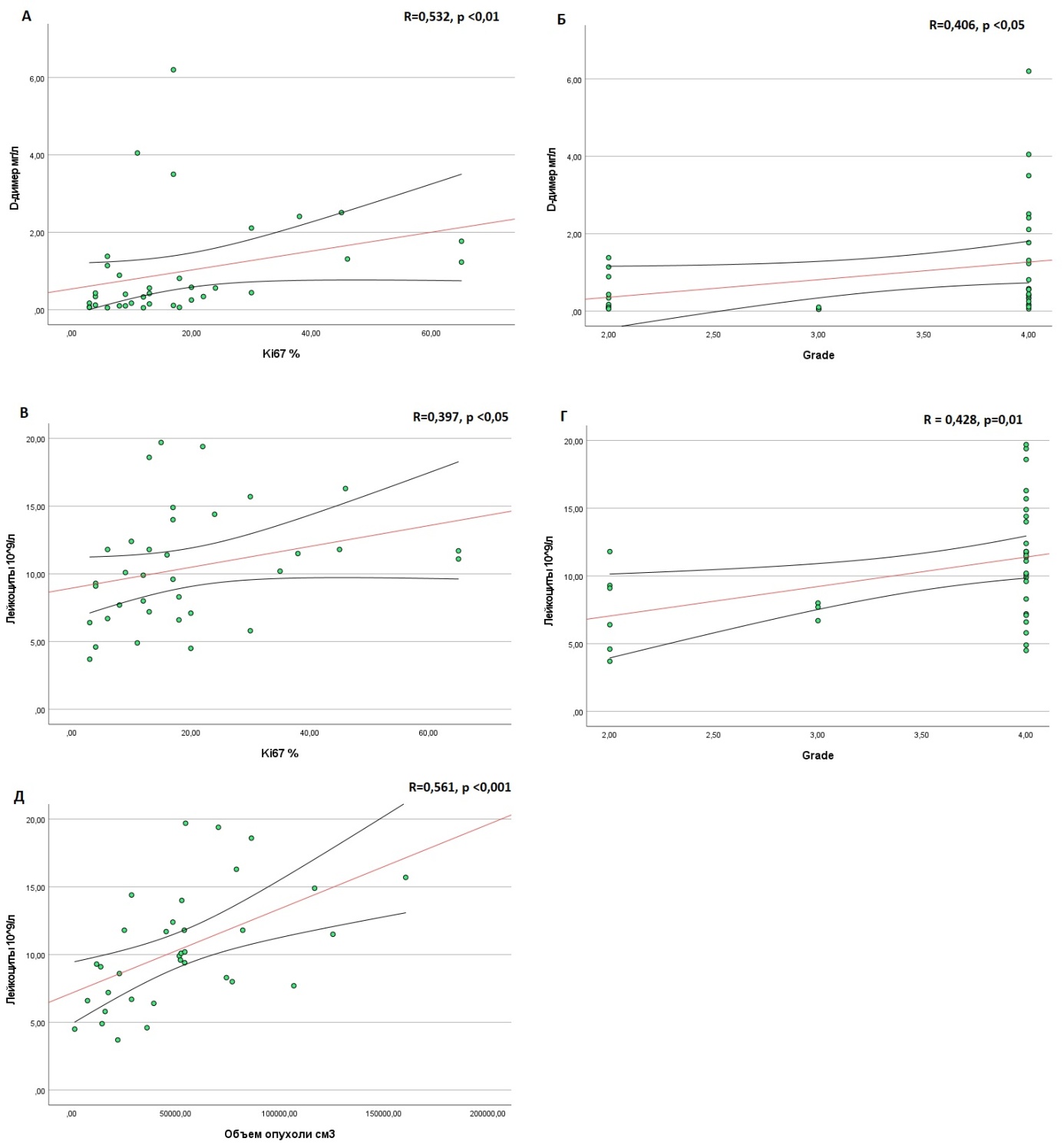
Рисунок 4 - Корреляционная зависимость (по Спирмену) между лабораторными показателями и данными глиомы:
А – корреляция между D-димером и Ki67; Б – между D-димером и Grade глиомы; В – между лейкоцитами и Ki67; Г – между лейкоцитами Grade глиомы; Д – между лейкоцитами и объемом глиомы
Также было проведено сравнение между группами с глиомами и менингиомами, где статистически значимые различия были по АЧТВ (р<0,05), Hb(р <0,01), эритроцитам (р <0,05), лейкоцитам (р <0,001) и гематокриту (р <0,05) (табл. 5).
Таблица 5 - Сравнение показателей пациентов с глиомами c менингиомами
Исследуемые параметры | Глиомы, Ме [Q1; Q3] | Менингиомы, Ме [Q1; Q3] | p-значение |
n | 43 | 54 | |
Протромбин по Квику, % | 98,5 [89,0; 114,5] | 98,5 [90,9; 109,6] | 0,925 |
МНО, отн. ед. | 1,00 [0,93; 1,06] | 1,00 [0,95; 1,05] | 0,919 |
АЧТВ, c | 29,1 [25,9; 32,9] | 30,5 [28,1; 33,8] | 0,046* |
Фибриноген, г/л | 2,6 [2,1; 3,1] | 2,36 [2,11; 2,88] | 0,635 |
D-димер, мг/л | 0,44 [0,14; 1,33] | 0,39 [0,19; 0,50] | 0,389 |
Aнтитромбин III, % | 107 [97; 115] | 105 [100; 116] | 0,883 |
Гемоглобин, г/л | 138 [128; 153] | 129 [122; 140] | 0,004* |
Эритроциты, 1012/л | 4,8 [4,3; 5,2] | 4,5 [4,2; 4,8] | 0,034* |
Лейкоциты, 109/л | 9,8 [7,3; 11,8] | 6,6 [6,2; 7,5] | <0,001* |
Тромбоциты, 109/л | 272 [220; 326] | 262 [229; 296] | 0,683 |
Гематокрит (Ht), % | 41 [37; 45] | 39 [36; 41] | 0,012* |
Примечание: * — статистически значимое различие; МНО - международное нормализованное отношение; АЧТВ - активированное частичное тромбопластиновое время
Снижение предоперационного АЧТВ по сравнению с менингиомами, вероятно, обусловлено повышением концентрации факторов свертывания крови в плазме. Повышение эритроцитов с гемоглобином может быть связан с ответом глиомы на гипоксию, стимулируя эритропоэз . Также очевидно повышение лейкоцитов характерно для глиом, в связи с более активным воспалительным ответом . В совокупности повышенный кровяной пул увеличивает вязкость крови, чем способствует тромбообразованию.
4. Обсуждение
У пациентов со злокачественными новообразованиями часто наблюдается нарушение равновесия между коагуляцией и фибринолизом, с тенденцией к гиперкоагуляции. Это явление связано с тромбозом, который является второй по распространенности причиной смерти среди таких пациентов. Опухоль способствует активации свертывающей системы, что ведет к образованию тромбов. В то же время активация свертывающей системы может также способствовать росту и прогрессированию опухоли. Некоторые исследования показали, что компоненты свертывающей системы могут стимулировать пролиферацию и метастазирование опухолевых клеток, что приводит к усилению процесса опухолевого роста. Таким образом, существует взаимосвязь между тромбозом и онкологическим процессом, которая может негативно повлиять на исход заболевания .
В нашем исследовании мы показали, что у пациентов с глиальными опухолями и тромбозом были выявлены значимое понижения МНО в 1,1 раз, АЧТВ в 1,2 раза, фибриногена в 1,4 раза (р<0,01)и тромбоцитов в 1,3 раза (р<0,05), и повышение — протромбина по Квику в 1,3 раз, и D-димера в 4,3 раз (р <0,01), лейкоцитов в 1,3 раз (р<0,05). Также значимо возраст после 60 лет увеличивал риска ВТЭО 18,7 в раз (р<0,001), артериальная гипертензия в 5,1 рази фенотип глиом IDH-wildtype в 5,8 раз ВТЭО (р <0,05). У пациентов с менингиомой и тромбозом значимо был повышен D-димера в 1,6 раз (р<0,01). Ожирение и увеличение возраста после 60 лет увеличивали риск ВТЭО соответственно в 4,9 раз и в 6 раз (р<0,05). Сравнивая гемостазиограмму и ОАК пациентов с глиомами, по сравнению с менингиомами, установлено уменьшение АЧТВ (р<0,05), увеличение значений Hb (р<0,01), эритроцитов (р<0,05), лейкоцитов (р<0,001) и гематокрита (р<0,05). Изменение показателей коагулограммы в сторону гиперкоагуляции и образование тромбов связаны с избыточной продукцией прокоагулянтых факторов опохолью, ключевую роль в котором играет ТФ. В работе Yerrabothala S. и др. показали, что дооперационный пик ТФ в плазме был выше у пациентов с менингиомами и глиомами, но в большей степени при последней. Также суперэкспрессия ТФ коррелирует с агрессивностью глиом . Не менее важным прокоагулянтом глиальных опухолей является подоплатин, который индуцирует агрегацию тромбоцитов, посредством активации C-лектинового рецептора типа 2 (CLEC-2). В исследовании J. Riedl и др. была обнаружена корреляция экспрессии подопланина с высоким уровнем D-димера и низким числом тромбоцитов в крови. Получается, что уменьшение количества тромбоцитов может играть значимую роль в развитии ВТЭО, поскольку глиомы высокой степени злокачественности ассоциированы с развитием тромбоза, опосредованного подопланином. Объяснение тому почему же происходит снижение тромбоцитов в крови при глиомах, предположительно связано с их потреблением в процессе агрегации, вызванной подопланином, что в последствии приводит к образованию внутриопухолевых внутрисосудистых скоплений тромбоцитов .
Глиомы с IDH диким типом (IDH-wildtype), к которым относятся глиообластомы, обладают наибольшим риском ВТЭО, чем мутантные фенотипы IDH1 или IDH2. D. Unruh и др. изучили взаимосвязь между мутантами по IDH1/2 и сниженной экспрессией TФ (из-за гиперметилирования промотора гена F3), кальций-зависимым ингибированием агрегации тромбоцитов, посредством секреции D-2-гидроксиглутарата и отсутствием микротромбов в опухолях .
Важно отметить, что лейкоцитоз ассоциируется с ВТЭО у пациентов с опухолями. Активация нейтрофилов сопровождается активацией свертывания крови и формированием тромбоцитарно-нейтрофильных микроагрегатов. Нейтрофилы способны усиливать тромбоз путем высвобождения нейтрофильных внеклеточных ловушек (NETs) — сети волокон хроматина с антимикробными пептидами. Помимо этого, активированные нейтрофилы выделяют протеазы, которые расщепляют ингибитор пути тканевого фактора, тем самым увеличивают активность TФ , .
Хотя и существует множество исследований, раскрывающих аберрантный гемостаз глиом , , , , однако, причины тромбообразования при менингиомах остаются практически неизвестными. Возможным кандидатом, инициирующим гиперкоагуляционный статус, может быть фактор роста эндотелия сосудов (VEGF). VEGF, экспрессируемая менингиомой в ответ на гипоксию, является ключевой молекулой при развитии перитуморального отека, которая увеличивает проницаемость сосудов вокруг опухоли , что последовательно приводит к эндотелиальной дисфункции и возможно к VEGF-индуцированной экспрессии ТФ . Также немаловажен и тот факт, что менингиомы обладают чувствительностью к половым гормонам, при этом 70% этих опухолей экспрессируют рецепторы прогестерона, а 30% — рецепторы эстрогена . Важно отметить, что увеличение уровня половых гормонов в организме, которое может происходить при приеме комбинированных оральных контрацептивов, прогестинов, менопаузальной гормональной терапии (МГТ), во время беременности или при ожирении, не только не способствует росту опухоли, но и, вероятно, может инициировать развитие гиперкоагуляционного состояния .
Понимание тромбозов, связанных с опухолями имеет важное значение для разработки стратегий профилактики и лечения пациентов с неоплазиями. Одним из подходов является использование антикоагулянтной терапии, однако она сопряжена с увеличением риска внутричерепных кровотечений, поэтому важно идентифицировать пациентов с высоким риском тромбоэмболических осложнений для проведения эффективной тромбопрофилактики. А.В. Бервицкий и др. в своем исследовании показали, что ранее (в течении первых 24 часов) применение НМГ, с целью профилактики ВТЭО после нейрохирургического лечения не приводило к росту внутричерепным кровоизлияниям, но могло увеличивать тяжесть случившегося геморрагического осложнения .
В данном исследовании учитывались в основном предоперационные факторы развития ВТЭО, ассоциированные с пациентом и опухолью. Очевидно, что лечение, связанное с опухолями головного мозга, а именно применение глюкокортикостероидов, краниотомия, химиотерапия и радиотерапиязначительно увеличивают риск ВТЭО , . Посчитав сколько каждый фактор риска, связанный с пациентом и опухолью, и лечением вносит вклад развития тромбоэмболических событий поможет в создании стратифицированных шкал для показания к назначению антикоагулянтной профилактике.
5. Заключение
Повышенный риск развития ВТЭО связан с гиперкоагуляцией у пациентов с глиомами и менингиомами головного мозга. Значимыми факторами тромботического риска у пациентов с глиомой являются повышение концентрации протромбина, уменьшение МНО, АЧТВ, фибриногена и тромбоцитов, повышение уровней, D-димеров и лейкоцитов до операции, увеличение возраста, сопутствующая артериальная гипертензия, IDH-wildtype, с менингиомой — степень тромбинемии по уровню D-димеров, увеличение возраста и сопутствующее ожирение. Увеличение D-димера и лейкоцитов коррелирует с прогрессированием глиом. Выявлены статистически значимые различия между группами с глиомами и менингиомами по уровню АЧТВ, Hb, эритроцитов, лейкоцитов и гематокриту. Для выделения нейрохирургических пациентов с высоким риском ВТЭО необходимо создать индивидуальные шкалы оценки риска венозного тромбоза, которые будут учитывать особенности развития ВТЭО при интракраниальных опухолях, что позволит нейрохирургам проводить адекватную антитромботическую профилактику на пред-, пери- и постоперационном периодах.
